1. 국민의 건강과 특허, 그 특별한 관계
한국의 의약품 지출 경향의 특징을 살펴보기 위해서는 국민건강보험 총 진료비 중 약제비 비중을 살펴보면 된다. 약제비 지출 비중은 2001년 23.5%에서 2006년 29.4%로 증가하였고(OECD평균 17.8%차지, 2003년), 2001년 이후 5년간 약제비 증가율도 연평균 15.0%로 동일기간 진료비 증가율 10.6%에 비하여 증가속도가 매우 급속하게 나타났다건강보험 약제비 적정화 방안 (2006.05.03 보건복지부 보도자료). 또한, 사회보험을 가지고 있는 국가이면서도 약제비에 대한 사적 지출의 비중이 약 48%로 높다OECD Health Data 2008. 우리나라는 이러한 약제비 증가에 대한 대응으로써 2006년 12월부터 약제비적정화방안을 시행하고 있다.

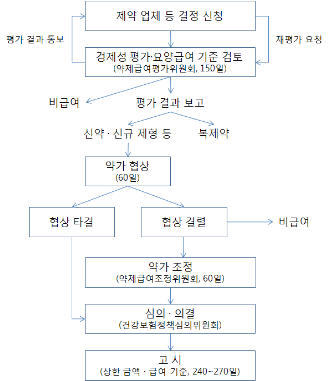
<그림 1. 건강보험 의약품 등재 절차>
제약 기업이 식품의약품안전청으로부터 특정 의약품의 제조․수입 품목 허가를 받으면 대체로 해당 의약품의 보험 등재 신청을 하게 된다. 우리나라 건강보험은 전 국민에게 적용되므로, 제약 기업으로서는 자사의 제품이 건강보험 적용을 받는 의약품으로 등재되면 판매에 유리해 진다. 이 때 의약품 가격은 건강보험공단과 제약 기업 간의 협상에 의해 결정하도록 되어 있다. 협상 결과 약가가 결정되면 건강보험정책심의위원회(이하 건정심)가 심의․의결한 후 보건복지가족부장관은 약가를 고시한다. 그러나 필수 의약품으로 인정된 의약품을 둘러싸고 공단과 기업의 가격 협상이 결렬되는 경우, 협상 결렬 이후 60일 안에 복지부의 약제급여조정위원회의 약가 조정과 건정심의 심의․의결을 거쳐 약가가 고시된다. 물론 필수 의약품으로 인정되지 않으면 해당 의약품은 비급여로 처리된다(그림)양준호. 건강보험 약가 관리 전반과 약제비 적정화. 제29차 약업 경영 세미나 <최근 의약품 허가 변화에 따른 대응 전략> 발표문. 2008년 4월 28일.
이러한 약가협상 방식은 국내 시장이 주 무대인 국내 제약회사에 비해, 전 세계 시장에서 독점적 영향력을 행사하고 있는 초국적 제약회사의 비싼 특허 신약의 가격을 조정하는데 한계가 있다. 순수하게 제품에 기반을 두었을 때, 제약회사의 협상력은 그 제품이 가지는 가치와 시장에서 다른 경쟁 상품들의 유무 및 그것과의 경쟁력에 달려있다. 반면 구매자의 협상력은 그 제품에 대한 시장규모에 의존한다. 희귀난치성 질환과 같이 시장이 한정되어 있을 경우나 생명에 꼭 필요한 의약품의 경우 구매자의 협상력은 제약 기업에 비해 상당히 떨어질 수밖에 없다. 따라서 협상에서의 선택은 결국 제약 기업이 원하는 약가를 책정하든지, 아니면 보험으로 약을 공급할 수 없게 되는 것이다.
선진국과 같은 거대 시장에 비해 한국과 같은 작은 시장은 현행 약제비 절감정책이 효과적으로 수행되기 어려운 위치에 있다. 특허 신약을 가진 초국적 제약회사들은 전 세계 동일약가 정책과 같은 전략을 구사하면서 일부 약에 대해 가격조정을 극도로 회피하고 있기 때문이다. 그리하여 일부 특허 신약들은 그것의 높은 가격으로 인한 접근권의 문제는 물론, 제약회사가 일방적으로 의약품을 공급하지 않는 상황마저 발생하고 있다.
의약품의 가격 결정 및 수급 문제에서 ‘특허’가 중요하게 다루어지는 이유는 첫 번째로 막대한 개발비용에 비해 일단 개발된 후에 이 결과물을 복제하는 데는 거의 비용이 들지 않는다는 점, 둘째, 의약분야에서는 특허에 의한 독점적 성격이 매우 강하게 나타난다는 점이다. 이는 의약품 특허가 물질특허로서 주 활성물질인 물질 자체가 의약품이라는 완제품에 오롯이 특허가 부여되는 특성이 반영되어 있다. 즉, 전자․기계와 같은 분야에서는 하나의 제품에 여러 특허가 존재하여 어느 한 기업이 완제품에 대한 기술독점을 지니기 어려운 반면, 의약 분야에서는 하나의 특허로 세계시장을 지배하는 것도 가능하기에 독점이 크게 영향을 미치게 된다. 세 번째로는 생명에 관계된 의약품일수록 특허는 과도한 독점가격을 형성할 수 있게 하여, 지구상 많은 사람들이 그 직접적 영향을 받아 생명과 건강에 막대한 손실을 가져오게 된다는 점이다.
이러한 상황 하에서 의약품에 대한 특허 발명의 ‘강제실시(compulsory license)’는 명백한 효용을 가진다. 필요한 환자들에게 생명을 구할 수 있는 의약품을 빠르게 낮은 가격으로 제공할 수 있다는 것이 그것이다.
2. 공공의 이익을 실현할 주체, 정부
보건의료는 정부의 역할이 강조되는 대표적인 영역이다. 정보의 비대칭성, 진입 장벽의 존재, 공급의 독점, 외부 효과 등 시장 경쟁이 원활하게 작동할 수 없는 요건을 고루 갖추고 있기 때문이다. 따라서 시장 기전이 자원을 효율적으로 배분하지 못하여 대체 불가능한 의약품을 쓰지 못하는 상황을 그대로 내버려두는 것은 정부의 직무 유기라 할 것이다.
다른 대부분의 선진국과 마찬가지로 한국도 의약품의 허가, 유통, 가격, 선별 등 많은 부분을 정부가 책임지고 있다. 특히 국민에게 꼭 필요한 의약품을 적절한 가격으로 필요한 시기에 공급하는 것은 정부가 담당해야 하는 중요한 책임이다. 제약 기업이 일방적으로 의약품의 공급을 거부하거나, 최근 신종 인플루엔자(이하 신종 플루) 대유행과 같은 상황처럼, 단시간에 의약품의 충분한 확보가 요구되는 경우 독점 기업의 생산량 또는 가격의 문제로 필수적인 의약품의 공급에 문제가 발생했을 때, 정부가 이에 대한 마땅한 조치를 취해야 함은 당연한 일이다. 경쟁이 없는 독점적인 특허 의약품에 대해서 취할 수 있는 대응은 현재로서 강제실시(특허법 제106조, 제107조)가 유일하며, 그것도 정부에 의한 특허 발명의 사용(특허법 제106조)이 제일 실현가능한 조치라 할 수 있다.
지난 2002년과 2008년, 우리나라에서는 백혈병 치료제 글리벡(Glivec)과 에이즈 치료제 푸제온(Fuzeon)의 높은 가격으로 인해 정부와 제약회사 간 가격 협상이 결렬되고 그로 인한 공급중단 사태가 발생했다. 당시 환자와 시민사회단체들은 직접 현 특허법 제107조특허법 제107조는 ‘통상실시권 설정에 관한 재정’에 관한 조항으로써, 특허청장이 “공공의 이익을 위하여 특히 필요할 경우”를 비롯한 5가지 사유에 대해 특허청장이 특허권자가 아닌 제3자에게 특허발명을 실시할 수 있도록 하고 있다.에 의거한 강제실시 청구, 즉 통상실시권 재정신청을 할 수 밖에 없었다. 공공의 이익을 위해 기업이 직접 강제실시를 청구하기를 기대하기란 어려웠기 때문이다. 강제실시를 청구한 시민사회단체는 위탁생산이나 수입을 고려하였으나, 강제실시가 확정된 것도 아닌데 공공제약회사도 아닌 사기업이 약을 생산하겠다고 약속할 리는 없었다.
특허청은 두 의약품에 대한 강제실시 청구에 대해 의약품의 공급이 ‘공공의 이익’에 해당한다는 것은 인정하면서도, 청구주체가 실시‘실시(實施)’란 특허 받은 발명을 생산․사용․양도․대여 또는 수입하는 행위를 총칭하는 말이다.(특허법 제2조) 또한, ‘실시권’은 특허권자 이외의 자가 업으로서 특허 발명을 실시할 수 있는 권리를 말한다.의 능력을 가지고 있느냐를 중요하게 고려하였다. 그러나 글리벡과 푸제온의 강제실시 청구 사례에서 살펴보듯 사기업인 제약회사는 ‘공공의 이익’을 위하여 강제실시를 청구할 동기가 전혀 없고, 약이 필요한 환자단체나 제약회사의 탐욕을 고발하는 시민단체는 강제실시를 청구할 수는 있으나 실질적으로 생산 및 수입을 할 능력을 갖춘 경우는 거의 없다. 환자와 시민단체에게 강제실시가 허락되어 위탁생산을 하더라도 국내 제약회사들은 초국적 제약회사와 여러 의약품으로 이해관계에 얽혀있고, 특허소송 등에 휘말릴까 두려워하므로, 정부의 보증 없이는 강제실시를 주저할 수밖에 없다. 결국 이 두 사례들은 의약품의 경우 강제실시의 주체로 정부가 나서야 한다는 것을 확인해 주었다.
최근 신종 플루 대유행 때문에 정부와 정치권, 시민 단체 등 우리 사회 일각에서는 항바이러스 치료제인 타미플루(Tamiflu)에 대한 강제 실시 필요성이 제기된 바 있다. 타미플루는 공급사인 로슈(Roche)의 생산량에 좌지우지 될 수밖에 없었으나, 당시 정부가 신종 플루의 빠른 확산으로 우왕좌왕하는 사이에 11월경이면 약이 바닥날 것이라 예상되는 상황이었다. 그러나 타미플루의 제네릭(generic) 의약품특허로 보호받는 의약품과 실질적으로 동일한 발명으로 보이는 의약품을 통상적으로 일컫는 말로, 흔히 복제약 또는 카피(copy)약이라 불린다. 의약품에 대한 특허가 없거나, 특허 보호 기간이 만료되었을 때 특허를 가진 제약회사 외의 다른 제약회사는 제네릭 의약품을 생산할 수 있다. 제네릭 의약품의 가격은 같은 효능을 지닌 특허 의약품에 비해 매우 저렴하다. 일례로 스위스계 초국적 제약회사 노바티스(Norvatis)가 전 세계적으로 독점 생산하고 있는 백혈병 치료제 ‘글리벡(Gleevec)’은 2003년 국내 가격이 한 알에 23,035원이었다. 그러나 2003년 1월 인도의 제약회사 ‘나코(Natco)’가 생산하는 글리벡의 제네릭 의약품인 ‘비낫(Veenot)’ 한 알에 2달러, 약 2천원 정도였다. 당시 글리벡의 생산 원가는 845원으로 알려져 있었다을 생산할 준비가 되어있는 국내 제약회사 중 단 1곳도 특허법 제107조에 따라 강제실시를 청구하지 않았다. 의약품의 허가, 보험등재여부, 가격결정 등의 책임을 맡고 있는 정부의 눈치를 볼 수밖에 없는 국내 제약회사들은 “정부의 정책에 맞설” 생각이 없기 때문이다. 결국 특허법 제107조가 있음에도 불구하고 실제로 의약품의 가격결정과 공급의 실질적인 주체로서 정부가 특허발명을 실시할 수 있도록, 사문화되다시피 한 특허법 제106조의 현실화가 필요했다.
3. 통상마찰과 의약품 강제실시
강제실시는 전 세계적으로 빈번하게 활용되는 합법적인 조치이며, 특정 국가의 강제실시의 시행이 무역관련지적재산권 협정(TRIPs, 이하 TRIPs 협정)에 대한 위반이라는 이유로 기소된 경우는 극히 드물다Chaudhuri, Sudip., The WTO and India’s Pharmaceuticals Industry: Patent Protection, TRIPs, and Developing Countries, New Delhi: Oxford University Press. 특히 강제실시에 따른 분쟁이 WTO(세계무역기구) 분쟁 해결 제도를 통해 공식적으로 논의된 사례 역시 찾아보기 어렵다Ho, Cynthia M. "Patent Breaking or Balancing? Separating Strands of Fact from Fiction Under TRIPS". Nortch Carolina Journal of International Law and Commercial Regulation, Vol. 34, 2009.
2001년, ‘도하선언’으로 알려져 있는 『TRIPs 협정과 공중의 건강에 대한 선언문』에서는 WTO 회원국들이 공중보건을 보호할 권리, 특히 모든 사람의 의약품 접근을 옹호하는 방식으로 TRIPs 협정이 해석되고 실행되어야 함과 강제실시를 부여할 권리와 그 ‘요건(grounds)’을 결정할 주권이 각 회원국에 있음을 확인하였다. 특히 선언문 4절은 “회원국이 공중의 건강을 보호하기 위한 조치를 TRIPs 협정이 ‘방해하지 않으며 방해할 수 없다(does not and should not prevent)’는 점에 합의한다.”라는 문구를 사용하였다. 그 배경은 경제적으로 선진국에 의한 무역보복 등을 염려하여 강제실시를 할 수 없는 현실적 문제 등을 염두에 둔 것이다. 즉, 이 배경 하에서 의약품에 대한 강제실시에 대해 무역보복이 행해지는 것은 단순히 윤리적 문제제기를 넘어 도하선언을 위배하는 것이 된다. 또한, WHO(세계보건기구) 역시 필수의약품에 대한 접근성을 확보하기 위해 강제실시를 활용할 것을 강력히 권고한 바 있다WHO, Improving Access to Medicines in Thailand: The use of TRIPS flexibilities, 2008.
강제실시가 실제로 국제적 수준의 법적 분쟁을 일으킬 가능성은 매우 낮으며, 특정 국가에 경제적․사회적 해를 끼친 사례 역시 거의 확인하기 어렵다. 선진국에서 강제실시로 인해 경제적․사회적 해를 입은 경우는 없거니와, 무엇보다 태국, 인도네시아, 브라질과 같이 강제실시를 시행한 국가들이 실제로 어떤 경험을 하였는지에 집중할 필요가 있다. 이들 국가의 경험은 모두 강제실시로 인해 법적 분쟁이나 무역 분쟁이 발생할 가능성이 예상보다 훨씬 낮으며, 강제실시에 따른 경제적 피해 역시 그 순기능 및 혜택과 비교할 때 상대적으로 매우 미미하다는 것을 분명히 예증하고 있다.
2006년~2007년간 총 7회의 의약품 강제실시를 실행한 태국은 강제실시의 경제적 효과를 구체적으로 검증하였고, 그 결과 강제실시가 사회복지의 증진을 통해 국가 경제에 긍정적인 효과를 낳았다고 평가한 바 있다. 태국 보건복지부는 강제실시로 인해 미국과의 통상 마찰을 일으킬 것으로 우려하였으나 실제로 이러한 우려는 현실화되지 않았다. 강제실시 전후의 대미(對美) 무역 지표를 분석한 결과 장기적으로 강제실시가 무역 관계에 끼치는 영향은 미미한 것으로 나타난 반면, 태국에서의 강제실시는 향후 5년 간 약 225,500,000달러(USD)의 보건 재정 지출을 절감해 줄 수 있을 것으로 추산하고 있다. 또한, 약 50인의 정부 관계자, 학자, 사업가에게 강제실시의 효과에 대한 설문조사를 한 결과 학계 및 재계의 전문가들은 강제실시 정책에 따른 긍정적 효과에 대체로 높은 만족감을 드러낸 것으로 보고하고 있다Health Intervention and Technology Assessment Program, "The implications of Thailand’s compulsory licensing policy, 2006-2008", Conference Presentation: Seoul, 2008 September.
4. 특허법 제106조의 개정 의미
신종 플루 사태에서 제기된 타미플루 강제실시 요구에 대해, 우리 정부는 “통상마찰 발생” 가능성 및 “기술개발 의욕 저하”라는 추상적 근거만 내세우며, 강제실시에 대해 사실상 부정적 의사를 표시하였다. 특히 현행 특허법에서도 정부의 특허 발명 실시 요건을 ‘전시․사변 또는 이에 준하는 비상시’로 극히 제한시켜 놓았기에, 논의는 더 진전되지 못하였다. 그러나 적지 않은 국가들이 정부의 정책 수단을 다양화하고 제약 기업 등과의 협상력을 높이는 데 강제실시를 유효적절하게 활용하고 있다. 이것은 경제․사회 발전 수준을 막론하는 국제적 관행이며, WTO의 TRIPs 협정이나 도하 선언 등 국제조약에서 보장하고 있는 바다.
단일한 건강보험체계를 갖고 있는 한국 정부는 필수약제에 대한 최대의 공급자로서, 의약품 수급문제에 있어 직접적인 책임을 갖고 있는 주체이다. 즉, 적정한 가격으로 의약품을 공급하고 접근성을 유지시키는 것은 국민의 건강을 위해 정부가 담당해야 할 중요한 부분이다. 그러나 의약품, 특히 특허 신약을 공급하는 초국적 제약 기업의 전 세계 동일약가정책에 대한 정부의 규제는 이들과의 협상수단의 부재로 한계에 봉착해 있는 상황이다. 그럼에도 불구하고 특허발명의 정부 사용에 대한 현 특허법의 규정은 특허로 인해 발생할 수 있는 공중보건상의 문제와 관련하여 WTO가 채택한 『TRIPs 협정과 공중의 건강에 대한 선언문』을 반영하고 있지 못하다. 따라서 특허발명의 정부 사용을 규정한 현행 특허법 제106조의 개정은 정부가 국민의 건강을 보호, 증진해야할 의무의 실현을 위한 최소한 노력임과 동시에, 국제적 차원의 제도적 논의를 국내에 반영하는 의미가 있다.
2009-12-20
특허권 강제실시에 관한 글 잘 읽었습니다.
특허권 강제실시 제도에 대한 내용을 모르고 있었는데 새롭게 알게된 내용이네요.
법의 취지가 충분히 이해가 가지만, 실질적 적용을 위한 현실적 대안이 필요한 듯 합니다.
정부관료들의 경우, 본인의 자리를 유지 보존하고자 하는 속성을 지니고 있는 터라, 본인이 책임져야할 부분이 생기는 것에 관해서는 사명감을 가지고 소신있게 일할 사람이 많지 않을 겁니다.
이에 제도적으로 대표격인 민/관/기업이 함께 할 수 있는 위원회를 통한 결정을 이끌어 내어 진행하는 것이 부담을 줄여줄 수 있지 않을까 생각해 봅니다.
함께 고민하고 싶은 사람이고 싶습니다.
언제라도 함께 고민하길 원하시면 연락주십시오. 감사합니다.
필리핀에서…